高校化学の問題演習
令和5年3月12日
酸化還元滴定
※関西学院大学の入試問題です。
※入力は次の指示にしたがってください。
- 入力は、半角で入力すること。
- 分数は、たとえば分母が4で分子が1なら1/4のように、(分子)/(分母)の形で入力すること。
- 累乗やイオン式にある+や-など右上に小さくあるものについては、たとえば「3の2乗」なら3^2、塩化物イオンならCl^-のように、^を使って入力すること。
- 化学式やイオン式で下付き数字を使う場合は、たとえばH2OならH2Oのように、そのまま入力すること。
濃度未知の二クロム酸カリウム水溶液(A液),濃度未知の硫酸鉄(Ⅱ)アンモニウム水溶液(B液),濃度が$c$〔mol/L〕(0.02mol/Lに近い)の過マンガン酸カリウム水溶液(C液)がある。ただし、これらの溶液は硫酸で酸性にしている。まずB液を10mLとりC液で滴定すると終点までに$a$〔mL〕要した。この反応は次のように書ける。
$\ce{5Fe^{2+} + MnO4^- + 8H+ -> 5Fe^{3+} + Mn^{2+} + 4H2O}$ …(1)
$\ce{5Fe^{2+} + MnO4^- + 8H+ \\ -> 5Fe^{3+} + Mn^{2+} + 4H2O}$ …(1)
次に、別にA液10mLをとり、これにB液20mLを加えた。加え終わるまでに二クロム酸イオンによる色は完全に消えた。この反応は次のように書ける。
$\ce{\fbox{ア} + $n$Fe^{2+} + 14H+ -> \fbox{イ} + $n$Fe^{3+} + 7H2O}$ …(2)
$\ce{\fbox{ア} + $n$Fe^{2+} + 14H+ \\ -> \fbox{イ} + $n$Fe^{3+} + 7H2O}$ …(2)
この溶液中に残っている$\ce{Fe^{2+}}$の量を知るために、この溶液をC液で滴定すると終点までに$b$〔mL〕要した。以上の結果からA液中の二クロム酸イオンの濃度が求まる。
問1 文中の$\fbox{$\hskip1em\Rule{0pt}{0.5em}{0em}$}$を埋めよ。
問2 イオン反応式(2)の係数$n$に数字を入れよ。
問3 B液の$\ce{Fe^{2+}}$の濃度〔mol/L〕を$a$,$c$を用いて表せ。
問4 A液の二クロム酸イオンの濃度〔mol/L〕を$a$,$b$,$c$を用いて表せ。
令和4年12月3日
反応速度の測定
※東京農工大学の入試問題です。
※入力は次の指示にしたがってください。
- 入力は、半角で入力すること。ただし、かけ算の「かける」という記号は全角の×で、矢印は全角の→で入力すること。
- 累乗は、たとえば「3の2乗」なら3^2のように、^を使って入力すること。
- 化学式で下付き数字を使う場合は、たとえばH2OならH2Oのように、そのまま入力すること。
※必要があれば、次の原子量を使用してください。
$\ce{H}$:1.0 $\ce{C}$:12.0 $\ce{O}$:16.0
次の文章を読んで、〔1〕~〔7〕の問いに答えなさい。
化学反応の速さは、単位時間に変化する反応物または生成物の変化量で表すことができ、反応が一定体積の中で行われる場合は、反応物または生成物の濃度の変化量として表すことができる。(1)希塩酸中で起こる酢酸エチルの加水分解反応では、反応溶液の体積はほとんど変化しないので、反応の速さは、反応時間の経過とともに生じる酢酸の濃度を順次調べることにより求めることができる。酢酸の濃度は、水酸化ナトリウム水溶液を用いた滴定により求められる。実際に、以下の①~⑤の手順で、酢酸エチルの加水分解速度を求める実験を行い、得られた結果を表1に示した。
〈実験〉
① 酢酸の滴定に用いる水酸化ナトリウム水溶液を用意した(溶液A)。その濃度は0.100mol/lであった。
② 希塩酸98.0mlを密閉できる容器に入れ、25℃に保った(溶液B)。
③ 酢酸エチルを2.00mlはかりとり、溶液Bに入れ、すばやくかくはんして完全に均一の溶液とした(溶液C)。
④ 混合直後(反応開始後0分)に、溶液Cを5.00mlとり出し、水25.0ml(指示薬を含む)に加え、溶液Aですばやく滴定した。
⑤ 反応開始後30分,60分,120分にもそれぞれ④と同様の操作を行い、滴定した。
| 反応時間(min)* | 0 | 30 | 60 | 120 |
| 中和に要した溶液Aの量(ml) | 25.0 | 26.2 | 27.3 | 29.2 |
*1min = 1分
〔1〕下線(1)の反応を化学反応式で表しなさい。
〔2〕酢酸エチルの密度を0.902g/cm3として、反応開始前の溶液C中の酢酸エチルのモル濃度を有効数字2けたで求めなさい。ただし、この時の溶液Cの体積は100mlとしてよいものとする。
〔3〕溶液C中の塩酸のモル濃度を有効数字2けたで求めなさい。ただし、混合直後(反応開始後0分)には、酢酸エチルの加水分解反応は全く進行していないものとする。
〔4〕反応開始後30分の溶液C中の酢酸エチルのモル濃度を有効数字2けたで求めなさい。答えだけでなく求め方も示しなさい。
〔5〕反応開始0分から30分までの酢酸エチルの平均加水分解速度を有効数字2けたで求めなさい。
〔6〕酢酸エチルの加水分解速度$v$は、反応速度定数$k$,酢酸エチルのモル濃度[酢酸エチル],水のモル濃度$[\ce{H2O}]$を用いて、$v = k[酢酸エチル][\ce{H2O}]$で表される。ここで、水は大過剰に存在するので、反応が進行しても水の濃度は一定と考えることができる。すなわち、$v = k'[酢酸エチル]$と考えてよいことになる。ここで、$k'$は擬一次反応速度定数と呼ばれる定数である。反応開始0分から30分までの平均酢酸エチル濃度と〔5〕で求めた平均加水分解速度の値を用いて、$k'$の値を有効数字2けたで求めなさい。答えだけでなく求め方も示しなさい。
〔7〕(a)温度を上げた場合、(b)反応開始時の酢酸エチルの濃度を小さくした場合、$k'$の値はそれぞれどうなると予想されるか、次の(1)~(3)から選んで番号を書きなさい。(半角数字のみ入力し、カッコは入力しなくてよい。)
(1) 小さくなる (2) 変わらない
(3) 大きくなる
令和4年9月11日
硫酸の性質
※愛知教育大学の入試問題を参考に作られています。
工業的に硫酸をつくるには、酸化バナジウム(Ⅴ)を触媒として二酸化硫黄を空気中の酸素と反応させ、生成した三酸化硫黄を濃硫酸に吸収させて ア 硫酸にし、これに水を反応させて得る。この方法を、 イ 法という。硫酸は無色の重い液体で不揮発性である。また、硫酸の濃度によって程度は異なるが、強酸性、脱水作用、酸化作用などの性質を示す。
問1 文中の空欄 ア , イ に適切な語句を記せ。
問2 次のi)~ii)の反応を化学反応式で示せ。ただし、i)については化学反応式中に硫酸を記す必要はない。(矢印以外はすべて半角で入力し、化学式で下付き数字を使う場合は、たとえばH2OならH2Oのように、そのまま入力すること。)
i) 濃硫酸を約170℃に加熱し、エタノールを反応させると気体が発生する。
ii) 塩化ナトリウムに濃硫酸を加えて加熱すると気体が発生する。
問3 濃硫酸と水を混合して希硫酸をつくるとき、水をかき混ぜながら濃硫酸を少しずつ加えるのと、濃硫酸をかき混ぜながら水を少しずつ加えるのでは、どちらの方法が適切か。理由とともに記せ。
問4 硫酸の製造原料に黄鉄鉱($\ce{FeS2}$)60.0kgを用いると、密度1.84kg/cm3の濃硫酸(98.0%)を何Lつくることができるか、小数第1位まで求めよ。ただし、原子量は$\ce{H}$ = 1.0,$\ce{O}$ = 16,$\ce{S}$ = 32,$\ce{Fe}$ = 56とする。なお、$\ce{FeS2}$は次式のように完全に反応するものとする。(半角のみで入力すること。)
$\ce{4FeS2 + 11O2 -> 2Fe2O3 + 8SO2}$
令和4年6月12日
中和滴定と滴定曲線
※香川大学の入試問題です。
※必要があれば、次の値を使用してください。
$\ce{H}$ 1.00 $\ce{C}$ 12.0 $\ce{O}$ 16.0
次の文章を読み、各問いに答えなさい。計算問題では計算過程も示し、有効数字2桁まで求めなさい。
中和滴定により、食用酢(酢酸溶液)の濃度を調べた。その実験操作は次のとおりである。まず、食用酢を正確に5倍に希釈した。次に、希釈した食用酢10.0mlを正確にホールピペットを用いてコニカルビーカーにはかりとり、(a)指示薬を数滴加えた。最後に、ビュレットを用いて、濃度が正確に0.100mol/lである$\ce{NaOH}$溶液で滴定した。その結果、過不足なく中和したときの、この$\ce{NaOH}$溶液の量は14.00mlであった。
問1 希釈前の食用酢中の酢酸のモル濃度は、いくらか答えなさい。
問2 希釈前の食用酢中の酢酸の濃度は、質量パーセントでいくらになるか答えなさい。ただし、この希釈前の食用酢の密度は1.00g/cm3とする。
問3 今回の中和滴定の操作の際の、滴定曲線を表したものは、下記の(ア)~(エ)のうちどれか、記号で答えなさい。(全角カタカナで入力すること)
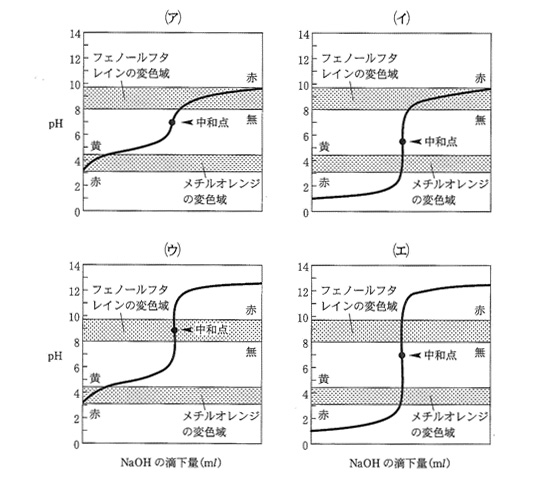
問4 今回の滴定で用いた(a)指示薬について、下記のうち正しいものはどれか、記号で答えなさい。また、その理由を簡潔に答えなさい。(半角アルファベットの小文字で入力すること)
(a) フェノールフタレインを用いるべきである。
(b) メチルオレンジを用いるべきである。
(c) フェノールフタレイン,メチルオレンジのどちらでも良い。
令和4年2月20日
溶液の浸透圧
※東京医科歯科大学の入試問題を参考に作られています。
※入力は次の指示にしたがってください。
- 入力は、半角で入力すること。かけ算の「かける」という記号のみは全角の×で入力すること。
- 累乗は、たとえば「3の2乗」なら3^2のように、^を使って入力すること。
人体の水分(体液)が急速に失われた場合、体液バランスの補正や維持のために(ア)0.9%(質量パーセント濃度)塩化ナトリウム水溶液を体内に補う医療行為が行われる。その理由として、人では血液から血球を除いた成分(血しょう)の浸透圧が0.9%塩化ナトリウム水溶液の浸透圧と等しいことが知られているからである。
しかし、血しょうの浸透圧は電解質のみによるものではなく、血液中に存在するタンパク質や糖なども寄与している。実際には、血液中のタンパク質濃度低下により、むくみが生じることが知られている。そこで、(イ)血しょう中に存在する分子量1万以上の高分子が寄与する浸透圧について図3のような装置を用いて調べた。
【実験1】 素焼きの円筒容器の壁に、はがれないように半透膜を接着させた。半透膜を隔てて円筒容器の内側と外側に蒸留水と0.9%塩化ナトリウム水溶液を入れた。その際、円筒容器の内側と外側の液面の高さが同じになるように加えた。そのまましばらく放置したが、液面の高さに変化は生じなかった(図3a)。
【実験2】 実験1と同じ半透膜を用いて、円筒容器の内側と外側に血しょうと0.9%塩化ナトリウム水溶液を入れた。その際、円筒容器の内側と外側の液面の高さが同じになるように加えた。しばらくすると、ガラス管内の液面が上昇し、両液面の差($h$)が40cmで平衡状態となった(図3b)。
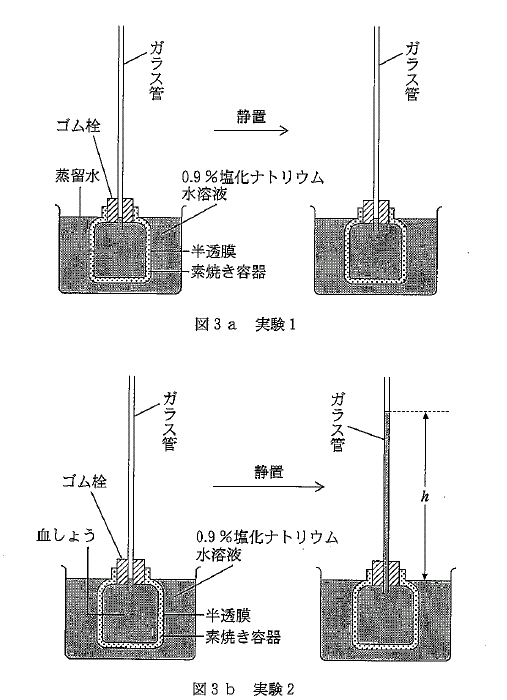
測定における温度条件は27℃とする。また、素焼きの容器は半透膜を隔てた物質の移動には関与しない。以下の各問に答えよ。必要のある場合には次の数値を用いよ。
原子量:$\ce{H}$ = 1.0 $\ce{C}$ = 12 $\ce{O}$ = 16
$\ce{Na}$ = 23.0 $\ce{Cl}$ = 35.5
気体定数:\( \displaystyle R = 8.31×10^3\frac{\rm{Pa・L}}{\rm{K・mol}} \)
問1 27℃における下線部(ア)の浸透圧(Pa)を有効数字3桁で答えよ。ただし、塩化ナトリウム水溶液の濃度は0.900%,水溶液の密度は1.00g/cm3,塩化ナトリウムの電離度は1.00とする。
問2 下線部(ア)の水溶液と同じ浸透圧を示すブドウ糖水溶液を100mL調製した。そのとき必要なブドウ糖($\ce{C6H12O6}$)の質量(g)を有効数字3桁で答えよ。
問3 この実験に使用する半透膜としてどのような性質を持った膜が適切であるか、20字以内で簡潔に述べよ。
問4 液面差が40.0cmであったとき、下線部(イ)の浸透圧(Pa)を有効数字3桁で答えよ。ただし0.9%塩化ナトリウム水溶液の密度は1.00g/cm3,血しょうの密度を1.02g/cm3とする。液の移動による密度の変化は考えないこととする。水銀柱では27℃,\( 1.01×10^5 \)Paのとき、高さは76.0cm,水銀の密度は13.6g/cm3である。
