高校化学の問題演習
令和3年11月28日
実験操作と薬品の取り扱い
※( )内の年度の大学入学共通テスト・センター試験の問題を参考に作られています。(答えはすべて半角数字で入力すること)
問1 塩化カルシウム$\ce{CaCl2}$には吸湿性がある。実験室に放置された塩化カルシウムの試料A11.5gに含まれる水$\ce{H2O}$の質量を求めるため、陽イオン交換樹脂を用いて次の実験Ⅰ~Ⅲを行った。この実験に関する下の問いに答えよ。
(2021(令和3))
実験Ⅰ 試料A11.5gを50.0mLの水に溶かし、$\ce{CaCl2}$水溶液とした。この水溶液を陽イオン交換樹脂を詰めたガラス管に通し、さらに約100mLの純水で十分に洗い流して$\ce{Ca^2+}$がすべて$\ce{H+}$に交換された塩酸を得た。
実験Ⅱ 実験Ⅰで得られた塩酸を希釈して500mLにした。
実験Ⅲ 実験Ⅱの希釈溶液をホールピペットで10.0mLとり、コニカルビーカーに移して、指示薬を加えたのち、0.100mol/Lの水酸化ナトリウム$\ce{NaOH}$水溶液で中和滴定した。中和点に達するまでに滴下した$\ce{NaOH}$水溶液の体積は40.0mLであった。
下線部に用いた器具と操作に関する記述として最も適当なものを、次の①~④のうちから一つ選べ。
① 得られた塩酸をビーカーで50.0mLはかりとり、そこに水を加えて500mLにする。
② 得られた塩酸をすべてメスフラスコに移し、水を加えて500mLにする。
③ 得られた塩酸をホールピペットで50.0mLとり、メスシリンダーに移し、水を加えて500mLにする。
④ 得られた塩酸をすべてメスシリンダーに移し、水を加えて500mLにする。
問2 ある物質の水溶液をホールピペットではかりとり、メスフラスコに移して、定められた濃度に純水で希釈したい。次の問い(a・b)に答えよ。
(2017(平成29))
a ホールピペットの図として正しいものを、次の①~⑤のうちから一つ選べ。
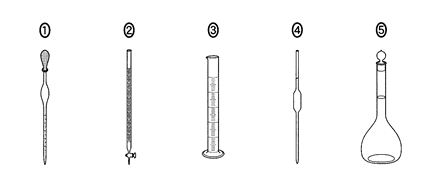
b このとき行う操作Ⅰ・Ⅱの組合せとして最も適当なものを、下の①~④のうちから一つ選べ。
操作Ⅰ
A ホールピペットは、洗浄後、内部を純水ですすぎそのまま用いる。
B ホールピペットは、洗浄後、内部をはかりとる水溶液ですすぎそのまま用いる。
操作Ⅱ
C 純水は、液面の上端がメスフラスコの標線に達するまで加える。
D 純水は、液面の底面がメスフラスコの標線に達するまで加える。
操作Ⅰ |
操作Ⅱ |
|
① |
A |
C |
② |
A |
D |
③ |
B |
C |
④ |
B |
D |
問3 実験の安全に関する記述として適当でないものを、次の①~⑤のうちから一つ選べ。
(2019(平成31・令和元))
① 薬品のにおいをかぐときは、手で気体をあおぎよせる。
② 硝酸が手に付着したときは、直ちに大量の水で洗い流す。
③ 濃塩酸は、換気のよい場所で扱う。
④ 濃硫酸を希釈するときは、ビーカーに入れた濃硫酸に純水を注ぐ。
⑤ 液体の入った試験管を加熱するときは、試験管の口を人のいない方に向ける。
令和3年8月8日
アニリンとその誘導体
※名古屋大学の入試問題を参考に作られています。
アニリンに関する以下の文章を読んで、設問(1)~(6)に答えよ。
アニリンはベンゼン環にアミノ基が一つ結合した化合物で、実験室では A を還元することで合成できる。具体的には A にスズを加え、さらに濃塩酸を加えて湯浴で加熱する。①反応が完結すると、最初二層に分かれていた反応液は均一になる。次に水酸化ナトリウム水溶液を加えて溶液を塩基性にしてから、ジエチルエーテルを加えてよく振ると、エーテル層にアニリンが抽出される。アニリンは油状の液体で、 B の水溶液を加えると赤紫色に呈色する。また空気や二クロム酸カリウムなどで十分に酸化すると、 C とよばれる黒色の生成物に変化する。
アニリンと無水酢酸を反応させると D が得られる。実際に D を合成する場合、アニリンと無水酢酸を直接混合するのは大きな発熱を伴うので危険である。そこでアニリンに、酢酸で希釈した無水酢酸の均一溶液をゆっくり加える。反応が完結したのち、この反応溶液を大量の冷水で希釈すると、水に対する溶解度の低い D が沈殿として得られる。
アニリンは芳香族アゾ化合物の原料でもある。アニリンの希塩酸溶液に亜硝酸ナトリウムを加えると②塩化ベンゼンジアゾニウムが生成し、これにナトリウムフェノキシド水溶液を加えると化合物 E が生成する。
設問(1):空欄A~Dに該当する物質あるいは化合物の名称を記せ。(全角のみで入力すること)
設問(2):下線部①で、反応が完結するとなぜ均一溶液になるのか。理由を30字以内で述べよ。
設問(3):アニリンと無水酢酸から化合物Dが生成する際の化学反応式を記せ。
設問(4):化合物Dに希硫酸を加えて加熱したところ、反応溶液から刺激臭がしてきた。この刺激臭をもつ物質は何か。化学式で答えよ。(半角のみで入力すること。下付き数字を使う場合は、たとえばH2OならH2Oのように、そのまま入力すること。)
設問(5):下線部②の塩化ベンゼンジアゾニウムが生成する化学反応式を記せ。また、塩化ベンゼンジアゾニウムは低温では水溶液中で安定に存在するが、加熱するとその一部は窒素を発生しつつ分解する。この分解反応で生成する有機化合物は何か。その構造式を記せ。
設問(6):化合物Eの構造式を記せ。
令和3年5月5日
鉄の性質
※岩手大学の入試問題を参考に作られています。(化学式で下付き数字を使う場合は、たとえばH2OならH2Oのように、そのまま入力すること。)
次の文章を読み、問1~問5に答えよ。
元素の周期表において、第4周期以降に現れる3族から11族に属する元素を遷移元素という。①鉄,銅,銀,金などの元素は遷移元素である。単体の鉄は天然にほとんど存在しないが、地殻中では鉄鉱石として広く存在する。単体の鉄はこの鉄鉱石を石灰石や (ア) とともに溶鉱炉(高炉)に入れ、高温で還元して得られる。この反応は、②高温で生成した一酸化炭素による還元反応である。このとき得られる鉄は (イ) とよばれ、炭素を約4%含んでいる。高温にした (イ) を転炉に移し、酸素を吹き込み、不純物や余分な炭素を除くと (ウ) が得られる。
鉄イオンには、鉄(Ⅱ)イオン$\ce{Fe^2+}$と鉄(Ⅲ)イオン$\ce{Fe^3+}$がある。$\ce{Fe^2+}$を含む水溶液に、アンモニア水または水酸化ナトリウム水溶液を加えると、化合物Ⓐの沈殿が生じる。また、$\ce{Fe^2+}$を含む水溶液に$\ce{K3[Fe(CN)6]}$水溶液を加えると (エ) 色の沈殿が生じる。$\ce{Fe^3+}$を含む水溶液にチオシアン酸カリウム水溶液を加えると (オ) 色の溶液になる。$\ce{Fe^2+}$は容易に酸化されて$\ce{Fe^3+}$になる。③酸性水溶液中における$\underline{\ce{Fe^2+}}$と二クロム酸カリウムとの反応は酸化還元反応を利用した定量分析の1つである。
問1.上の文章の (ア) ~ (オ) に適切な用語を書け。(全角のみで入力すること)
問2.化合物Ⓐの化学式を書け。(半角のみで入力すること)
問3.下線①の金属小片をそれぞれ、希硫酸水溶液に投入したところ、1つの金属小片は気体を発生して溶解した。この反応の化学反応式を書け。(矢印以外はすべて半角で入力すること)
問4.鉄鉱石が赤鉄鉱の場合、下線②の反応を化学反応式で示せ。(矢印以外はすべて半角で入力すること。)
問5.下線③の反応において、$\ce{Fe^2+}$を含む水溶液100mLを採取し、酸性にして、0.20mol/Lの二クロム酸カリウムを含む水溶液で滴定したところ、すべての$\ce{Fe^2+}$を$\ce{Fe^3+}$に酸化するのに20mLを要した。$\ce{Fe^2+}$のモル濃度〔mol/L〕を有効数字2
令和3年1月17日
溶解度積
※大阪市立大学の入試問題です。
※入力は次の指示にしたがってください。
- 入力は、半角で入力すること。かけ算の「かける」という記号は全角の×で、矢印は全角の→で入力すること。
- 累乗は、たとえば「3の2乗」なら3^2のように、^を使って入力すること。イオン式の場合も同じように、たとえば塩化物イオンならCl^-のように、^を使って入力すること。
- 化学式で下付き数字を使う場合は、たとえばH2OならH2Oのように、そのまま入力すること。
次の文章を読み、(1)~(4)の問いに答えよ。必要であれば次の値を用いよ。
塩化銀$\ce{AgCl}$の溶解度積
\( K_{sp1} = 1.8×10^{-10} \)mol2/L2
クロム酸銀$\ce{Ag2CrO4}$の溶解度積
\( K_{sp2} = 3.6×10^{-12} \)mol3/L3
\( \sqrt{1.8} \) = 1.34,\( \sqrt{10} \) = 3.16
水溶液中の塩化ナトリウム濃度を求める方法としてモール法が知られている。この方法では、濃度未知の塩化ナトリウム水溶液(試料溶液)に指示薬としてクロム酸カリウム$\ce{K2CrO4}$を加え、濃度既知の硝酸銀$\ce{AgNO3}$水溶液で滴定を行う。硝酸銀水溶液の滴下を開始すると、試料溶液中に塩化銀の白色沈殿が生成し始める。①滴下された硝酸銀の物質量と試料溶液中の塩化ナトリウムの物質量が一致する当量点に至るまで、銀イオンのほとんどが塩化銀として沈殿する。当量点をこえて滴下された硝酸銀の銀イオンは、指示薬のクロム酸イオンと反応し、赤褐色のクロム酸銀の沈殿を生成する。
(1) 下線部①の当量点において、試料溶液中にわずかに溶解する銀イオンの濃度〔mol/L〕を有効数字2桁で答えよ。
(2) 滴定が当量点に到達すると同時にクロム酸銀が沈殿し始めるようにするには、試料溶液中のクロム酸イオンの濃度〔mol/L〕をいくらにすればよいか。有効数字2桁で答えよ。ただし、滴定に伴う試料溶液の液量増加は、無視できるものとする。
(3) 実際には、滴定に伴い試料溶液の液量が増加する。いま、濃度未知の塩化ナトリウム試料溶液\( 2.0×10^{-1} \)Lにクロム酸イオン濃度が\( 5.4×10^{-3} \)mol/Lとなるようにクロム酸カリウムを溶解させた。この試料溶液を濃度\( 1.0×10^{-3} \)mol/Lの硝酸銀水溶液で滴定したところ、\( 1.0×10^{-1} \)Lを滴下し、試料溶液の液量が\( 3.0×10^{-1} \)Lとなったところで、クロム酸銀の赤褐色沈殿が生成し始めた。以下の(i)~(iii)に答えよ。
(i) クロム酸銀が沈殿し始めたとき、試料溶液に溶解している銀イオンおよび塩化物イオンの濃度〔mol/L〕はいくらか。それぞれ有効数字2桁で答えよ。
(ii) クロム酸銀が沈殿し始めたとき、試料溶液中に沈殿している塩化銀の物質量〔mol〕を有効数字2桁で答えよ。
(iii) 試料溶液中の塩化ナトリウム濃度〔mol/L〕を有効数字2桁で答えよ。
(4) モール法の滴定実験では、指示薬を溶解させた試料溶液および硝酸銀水溶液を中性付近に保つ必要がある。以下の(i)と(ii)に答えよ。
(i) 用いる溶液が酸性の場合、滴定を妨害する主な反応をイオン反応式で答えよ。
(ii) 用いる溶液が塩基性の場合、滴定を妨害する主な反応をイオン反応式で答えよ。
令和2年10月4日
物質量
※( )内の大学の入試問題で出題された問題です。(答えはすべて半角のみで入力すること)
※入力は次の指示にしたがってください。
- 入力は、半角で入力すること。かけ算の「かける」という記号は全角の×で入力すること。
- 累乗は、たとえば「3の2乗」なら3^2のように、^を使って入力すること。
次の問いに答えなさい。
問1 硫酸$\ce{H2SO4}$について、下の(1),(2)に答えよ。解答は有効数字2桁とし、必要ならば次の数値を利用せよ。
原子量 $\ce{H}$ = 1.0,$\ce{C}$ = 12.0,$\ce{O}$ = 16.0,$\ce{S}$ = 32.1
アボガドロ定数 \( N_A = 6.0×10^{23} \)〔/mol〕
(東北工業大)
(1) 294gあるとき、その物質量は何molか。
(2) 分子の数が\( 4.82×10^{24} \)個あるとき、その物質量は何molか。
問2 氷の0℃における密度は、0.92g/cm3である。体積1.0cm3の氷中に存在する水分子の数は何個か、有効数字2桁で答えよ。原子量$\ce{H}$ = 1.00,$\ce{O}$ = 16.0,アボガドロ定数\( N_A = 6.0×10^{23} \)/molとする。
(九州工業大)
問3 1.43gの気体が標準状態(0℃,\( 1.013×10^5 \)Pa)で1.00Lを占めるとき、その気体の分子量はいくらか。有効数字2桁まで求めよ。
(大阪歯科大)
