高校化学の問題演習
気体の法則
※名古屋大学の入試問題を参考に作られています。
※入力は次の指示にしたがってください。
- ×の記号のみ全角で、その他はすべて半角で入力すること
- 累乗は、たとえば「3の2乗」なら3^2、「5の-3乗」なら5^-3のように、^を使って入力すること
次の文章を読んで、設問(1)~(3)に答えよ。ただし、水蒸気および窒素は理想気体とみなし、窒素の水への溶解は無視する。また、解答は有効数字2桁で記せ。必要ならば、以下の気体定数の値を用いよ。
\( R = 8.3×10^3 \)Pa・L/(mol・K)
一定の温度に保たれたピストン付き容器がある。この容器に水および窒素をモル比2:1の割合で入れ、平衡になるまで放置した。次に、平衡が保たれるように注意しながら、容器の容積を1.0Lから5.0Lまで変化させた。このとき、容器内部の圧力は図1のように変化した。なお、水の体積は、容器の容積に比べて十分小さいので、無視してよい。
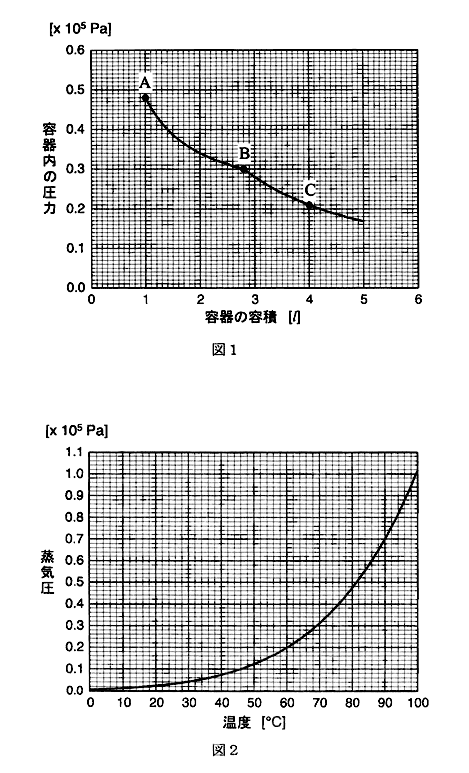
設問(1):図1のA点,B点,C点それぞれにおける水蒸気の分圧は何Paか。ただし、水の蒸気圧は、温度によって図2のように変化する。
設問(2):容器の温度は何℃か。
設問(3):容器に入れた水は何molか。
物質の三態と熱運動
※( )内の年度のセンター試験の問題を参考に作られています。(答えはすべて半角数字で入力すること)
問1 図1は物質の三態の間の状態変化を示したものである。 a ~ c に当てはまる用語の組合せとして最も適当なものを、下の①~⑥のうちから一つ選べ。
(2015(平成27))
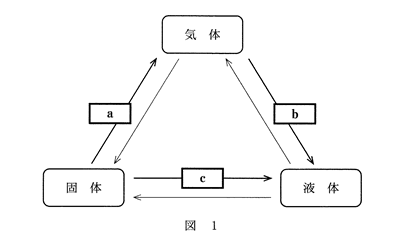
a |
b |
c |
|
① |
凝縮 |
昇華 |
融解 |
② |
凝縮 |
融解 |
昇華 |
③ |
昇華 |
凝縮 |
融解 |
④ |
昇華 |
融解 |
凝縮 |
⑤ |
融解 |
昇華 |
凝縮 |
⑥ |
融解 |
凝縮 |
昇華 |
問2 \( 1.013×10^5 \)Paのもとでの水の状態変化に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
(2018(平成30))
① ポリエチレン袋に少量の水を入れ、できるだけ空気を除いて密封し電子レンジで加熱し続けたところ、袋がふくらんだ。
② 氷水を入れたガラスコップを湿度が高く暖かい部屋に置いておいたところ、コップの外側に水滴がついた。
③ 氷を加熱し続けたところ、0℃で氷が融解しはじめ、すべての氷が水になるまで温度は一定に保たれた。
④ 水を加熱し続けたところ、100℃で沸騰しはじめた。
⑤ 水を冷却してすべてを氷にしたところ、その氷の体積はもとの水の体積よりも小さくなった。
問3 1種類の分子のみからなる物質の大気圧下での三態に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
(2017(平成29))
① 気体の状態より液体の状態のほうが分子間の平均距離は短い。
② 液体中の分子は熱運動によって相互の位置を変えている。
③ 大気圧が変わっても沸点は変化しない。
④ 固体を加熱すると、液体を経ないで直接気体に変化するものがある。
⑤ 液体の表面では常に蒸発が起こっている。
金属イオンの反応
※( )内の年度のセンター試験の問題を参考に作られています。(答えはすべて半角数字で入力すること)
問1 2種類の金属イオンを含む水溶液について、次の操作(a~c)を行った。どちらか一方の金属イオンのみを沈殿させることのできる操作はどれか。正しく選択しているものを、下の①~⑦のうちから一つ選べ。
(2008(平成20))
a $\ce{Al^3+}$と$\ce{Fe^3+}$を含む水溶液に、過剰のアンモニア水を加えた。
b $\ce{Cu^2+}$と$\ce{Ba^2+}$を含む水溶液に、希硫酸を加えた。
c $\ce{Ag+}$と$\ce{Pb^2+}$を含む水溶液に、硫化水素を吹き込んだ。
① a ② b ③ c ④ a・b
⑤ a・c ⑥ b・c ⑦ a・b・c
問2 3種類の未知の金属イオンを含む硝酸酸性水溶液を用いて、図1の操作Ⅰ~Ⅲを順に行った。これらの操作ごとに、異なる金属イオンを含む沈殿a~cが生成し、金属イオンを分離することができた。沈殿a~cに含まれる金属イオンはそれぞれ何か。最も適当な組合せを、下の①~⑤のうちから一つ選べ。
(2014(平成26))
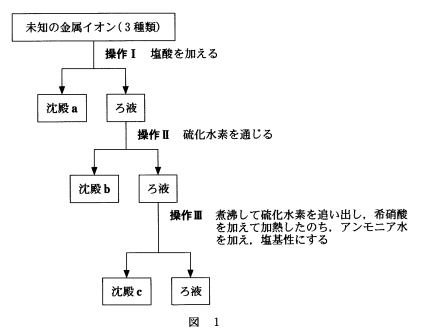
分離された金属イオン |
|||
沈殿a |
沈殿b |
沈殿c |
|
① |
$\ce{Ag+}$ |
$\ce{Pb^2+}$ |
$\ce{Cu^2+}$ |
② |
$\ce{Ag+}$ |
$\ce{Cu^2+}$ |
$\ce{Fe^3+}$ |
③ |
$\ce{Ag+}$ |
$\ce{Pb^2+}$ |
$\ce{Fe^3+}$ |
④ |
$\ce{Pb^2+}$ |
$\ce{Cu^2+}$ |
$\ce{Ca^2+}$ |
⑤ |
$\ce{Pb^2+}$ |
$\ce{Fe^3+}$ |
$\ce{Al^3+}$ |
問3 $\ce{Al^3+}$,$\ce{Ba^2+}$,$\ce{Fe^3+}$,$\ce{Zn^2+}$を含む水溶液から、図3の実験により各イオンをそれぞれ分離することができた。この実験に関する記述として誤りを含むものを、下の①~⑥のうちから一つ選べ。
(2016(平成28))
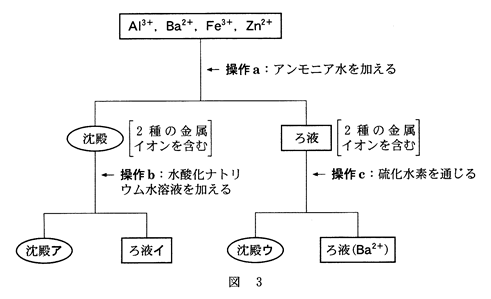
① 操作aでは、アンモニア水を過剰に加える必要があった。
② 操作bでは、水酸化ナトリウム水溶液を過剰に加える必要があった。
③ 操作cでは、硫化水素を通じる前にろ液を酸性にする必要があった。
④ 沈殿アを塩酸に溶かして$\ce{K4[Fe(CN)6]}$水溶液を加えると、濃青色沈殿が生じる。
⑤ ろ液イに塩酸を少しずつ加えていくと生じる沈殿は、両性水酸化物である。
⑥ 沈殿ウは、白色である。
電池の基本原理
※( )内の年度のセンター試験の問題を参考に作られています。(答えはすべて半角数字で入力すること)
問1 電池に関する次の文章中の ア ~ ウ に当てはまる語の組合せとして正しいものを、下の①~⑧のうちから一つ選べ。
(2016(平成28))
図1のように、導線でつないだ2種類の金属(A・B)を電解質の水溶液に浸して電池を作製する。このとき、一般にイオン化傾向の大きな金属は ア され、 イ となって溶け出すので、電池の ウ となる。
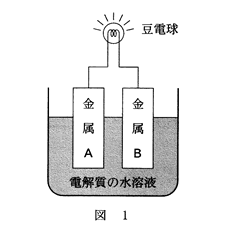
ア |
イ |
ウ |
|
① |
還元 |
陽イオン |
正極 |
② |
還元 |
陽イオン |
負極 |
③ |
還元 |
陰イオン |
正極 |
④ |
還元 |
陰イオン |
負極 |
⑤ |
酸化 |
陽イオン |
正極 |
⑥ |
酸化 |
陽イオン |
負極 |
⑦ |
酸化 |
陰イオン |
正極 |
⑧ |
酸化 |
陰イオン |
負極 |
問2 ある電解質の水溶液に、電極として2種類の金属を浸し、電池とする。この電池に関する次の記述(A~C)について、 ア ~ ウ に当てはまる語の組合せとして最も適当なものを、下の①~⑧のうちから一つ選べ。
(2010(平成22))
A イオン化傾向のより小さい金属が ア 極となる。
B 放電させると イ 極で還元反応が起こる。
C 放電によって電極上で水素が発生する電池では、その電極が ウ 極である。
ア |
イ |
ウ |
|
① |
正 |
正 |
正 |
② |
正 |
正 |
負 |
③ |
正 |
負 |
正 |
④ |
正 |
負 |
負 |
⑤ |
負 |
正 |
正 |
⑥ |
負 |
正 |
負 |
⑦ |
負 |
負 |
正 |
⑧ |
負 |
負 |
負 |
問3 電池に関する記述として下線部に誤りを含むものを、次の①~⑤のうちから一つ選べ。
(2015(平成27)・追試)
① 導線から電子が流れこむ電極を、電池の正極という。
② 電池の両極間の電位差を起電力という。
③ 充電によって繰り返し使うことのできる電池を、二次電池という。
④ ダニエル電池では、亜鉛よりイオン化傾向が小さい銅の電極が負極となる。
⑤ 鉛蓄電池では、鉛と酸化鉛(Ⅳ)を電極に用いる。
反応熱について
※( )内の年度のセンター試験の問題を参考に作られています。(答えはすべて半角数字で入力すること)
問1 次の熱化学方程式を利用すると、炭素の同素体について、物質のもつエネルギー(化学エネルギー)を比較することができる。同じ質量の黒鉛、ダイヤモンド、フラーレン$\ce{C60}$について、物質のもつエネルギーが小さいものから順に正しく並べられたものを、下の①~⑥のうちから一つ選べ。
(2009(平成21))
$\ce{C}\mbox{(ダイヤモンド)} + \ce{O2}\mbox{(気)} = \ce{CO2}\mbox{(気)} + 396\,\mathrm{kJ}$
$\ce{C60}\mbox{(フラーレン)} + \ce{60O2}\mbox{(気)} = \ce{60CO2}\mbox{(気)} + 25390\,\mathrm{kJ}$
$\ce{C}\mbox{(黒鉛)} = \ce{C}\mbox{(ダイヤモンド)} - 2\,\mathrm{kJ}$
$\ce{C}\mbox{(ダイヤモンド)} + \ce{O2}\mbox{(気)} \\ = \ce{CO2}\mbox{(気)} + 396\,\mathrm{kJ}$
$\ce{C60}\mbox{(フラーレン)} + \ce{60O2}\mbox{(気)} \\ = \ce{60CO2}\mbox{(気)} + 25390\,\mathrm{kJ}$
$\ce{C}\mbox{(黒鉛)} = \ce{C}\mbox{(ダイヤモンド)} - 2\,\mathrm{kJ}$
① 黒鉛<ダイヤモンド<フラーレン$\ce{C60}$
② 黒鉛<フラーレン$\ce{C60}$<ダイヤモンド
③ ダイヤモンド<黒鉛<フラーレン$\ce{C60}$
④ ダイヤモンド<フラーレン$\ce{C60}$<黒鉛
⑤ フラーレン$\ce{C60}$<黒鉛<ダイヤモンド
⑥ フラーレン$\ce{C60}$<ダイヤモンド<黒鉛
問2 植物の光合成には、二酸化炭素と水からグルコース$\ce{C6H12O6}$をつくり、酸素を放出する反応がある。この反応の熱化学方程式は、次の式で表すことができる。
$\ce{6CO2}\mbox{(気)} + \ce{6H2O}\mbox{(液)} = \ce{C6H12O6}\mbox{(固)} + \ce{6O2}\mbox{(気)} + Q\,\mathrm{〔kJ〕}$
$\ce{6CO2}\mbox{(気)} + \ce{6H2O}\mbox{(液)} \\ = \ce{C6H12O6}\mbox{(固)} + \ce{6O2}\mbox{(気)} + Q\,\mathrm{〔kJ〕}$
反応熱$Q$を、次の熱化学方程式を用いて計算すると、何kJになるか。最も適当な数値を、下の①~⑥のうちから一つ選べ。 1 kJ
(2011(平成23))
$\ce{6C}\mbox{(黒鉛)} + \ce{6H2}\mbox{(気)} + \ce{3O2}\mbox{(気)} = \ce{C6H12O6}\mbox{(固)} + 1273\,\mathrm{kJ}$
$\ce{C}\mbox{(黒鉛)} + \ce{O2}\mbox{(気)} = \ce{CO2}\mbox{(気)} + 394\,\mathrm{kJ}$
$\ce{H2}\mbox{(気)} + \ce{\displaystyle\frac{1}{2}O2}\mbox{(気)} = \ce{H2O}\mbox{(液)} + 286\,\mathrm{kJ}$
$\ce{6C}\mbox{(黒鉛)} + \ce{6H2}\mbox{(気)} + \ce{3O2}\mbox{(気)} \\ = \ce{C6H12O6}\mbox{(固)} + 1273\,\mathrm{kJ}$
$\ce{C}\mbox{(黒鉛)} + \ce{O2}\mbox{(気)} \\ = \ce{CO2}\mbox{(気)} + 394\,\mathrm{kJ}$
$\ce{H2}\mbox{(気)} + \ce{\displaystyle\frac{1}{2}O2}\mbox{(気)} \\ = \ce{H2O}\mbox{(液)} + 286\,\mathrm{kJ}$
① -4080 ② -2807 ③ -593
④ 593 ⑤ 2807 ⑥ 4080
問3 水に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
(2011(平成23))
① 水(固)が水(液)になるときに吸収する熱量を融解熱という。
② 水(液)が水(気)になるときに吸収する熱量を蒸発熱という。
③ 水(液)の生成熱は、\( 1.013×10^5 \)Pa(1atm),25℃において、水素(気)が燃焼して水(液)が生じるときの燃焼熱に等しい。
④ 水(固)の生成熱は、水(気)の生成熱より大きい。
⑤ 水(気)の生成熱は、水(液)の生成熱と水(液)の蒸発熱の和に等しい。
