この問題のポイント
反応熱を求める方法は、エネルギー図を使う方法と代数的に解く方法の2通り!
どちらの方法でも解けるようになることが重要!
問1 まず、中学の数学で習った連立方程式のやり方で、いらない物質を消去していくことで求めていく方法です。この問題では、どっちの物質がどっちの物質よりエネルギーが多い(少ない)のかがわかればいいので、(ある物質) = (別の物質)±○kJという形にすればいいわけです。
そこで、与えられた方程式を上からA,B,Cとします。Aの両辺を60倍すると、
$\ce{60C}\mbox{(ダイヤモンド)} + \ce{60O2}\mbox{(気)} = \ce{60CO2}\mbox{(気)} + 23760\,\mathrm{kJ}$ …D
そこで、与えられた方程式を上からA,B,Cとします。Aの両辺を60倍すると、
$\ce{60C}\mbox{(ダイヤモンド)} + \ce{60O2}\mbox{(気)} \\ = \ce{60CO2}\mbox{(気)} + 23760\,\mathrm{kJ}$ …D
ここでB-Dをすると
$\ce{C60}\mbox{(フラーレン)} - \ce{60C}\mbox{(ダイヤモンド)} = 2170\,\mathrm{kJ}$
$\ce{C60}\mbox{(フラーレン)} = \ce{60C}\mbox{(ダイヤモンド)} + 2170\,\mathrm{kJ}$ …E
ここでB-Dをすると
$\ce{C60}\mbox{(フラーレン)} - \ce{60C}\mbox{(ダイヤモンド)} \\ = 2170\,\mathrm{kJ}$
$\ce{C60}\mbox{(フラーレン)} \\ = \ce{60C}\mbox{(ダイヤモンド)} + 2170\,\mathrm{kJ}$ …E
そして、Cの両辺を60倍すると、
$\ce{60C}\mbox{(黒鉛)} = \ce{60C}\mbox{(ダイヤモンド)} - 120\,\mathrm{kJ}$ …F
ここで、問題にもあったとおり、同じ質量どうしで比べないといけなかったはずですが、C60(フラーレン)は1molで720g、黒鉛とダイヤモンド(どちらもC)は60molで720gです。ということは、C60と60C(ダイヤモンド)、60C(黒鉛)で比べないといけないわけです。
Eより、$\ce{C60}$はダイヤモンドよりエネルギーが大きく、Fより、黒鉛はダイヤモンドよりエネルギーが小さいということがわかります。ということは、黒鉛、ダイヤモンド、$\ce{C60}$の順にエネルギーが小さいとわかります。
もう1つの方法がエネルギー図を描いて求める方法です。この問題では同じ質量どうしで比べないといけないわけなんで、EとFの方程式を作らないといけないことに変わりはないですが、B,E,Fの方程式を使うとこのような図になります。
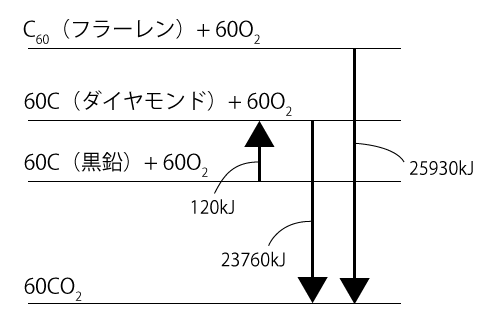
+○kJと結びついている場合はその物質を下に、-○kJと結びついている場合はその物質を上に書くというわけです。そして、エネルギー図では下にある物質のほうがエネルギーは小さいわけですから、やはり黒鉛、ダイヤモンド、$\ce{C60}$の順になっていますね。
問2 問題文にあった、二酸化炭素と水からグルコースと酸素をつくる反応の熱化学方程式を(1)とし、与えられた3つの熱化学方程式について、上からⅠ、Ⅱ、Ⅲとします。
まず、連立方程式のようなやり方で考える方法です。Ⅰ、Ⅱ、Ⅲの方程式を利用して、(1)の方程式を作っていけばいいわけですが、作っていくためには、Ⅰ、Ⅱ、Ⅲの中にある$\ce{H2}$や$\ce{C(黒鉛)}$がジャマです。ですから、それを消していきましょう。
まず、Ⅰ-Ⅱ×6をすると、以下の方程式ができて$\ce{C(黒鉛)}$が消えてくれます。
$\ce{6H2}\mbox{(気)} - \ce{3O2}\mbox{(気)} = \ce{C6H12O6}\mbox{(固)} - \ce{6CO2}\mbox{(気)} - 1091\,\mathrm{kJ}$ …Ⅳ
まず、Ⅰ-Ⅱ×6をすると、以下の方程式ができて$\ce{C(黒鉛)}$が消えてくれます。
$\ce{6H2}\mbox{(気)} - \ce{3O2}\mbox{(気)} \\ = \ce{C6H12O6}\mbox{(固)} - \ce{6CO2}\mbox{(気)} - 1091\,\mathrm{kJ}$ …Ⅳ
そして、Ⅳ-Ⅲ×6をすると、$\ce{H2}$も消えてくれます。
$\ce{-6O2}\mbox{(気)} = \ce{C6H12O6}\mbox{(固)} - \ce{6CO2}\mbox{(気)} - \ce{6H2O}\mbox{(液)} - 2807\,\mathrm{kJ}$
そして、Ⅳ-Ⅲ×6をすると、$\ce{H2}$も消えてくれます。
$\small{\ce{-6O2}\mbox{(気)} \\ = \ce{C6H12O6}\mbox{(固)} - \ce{6CO2}\mbox{(気)} - \ce{6H2O}\mbox{(液)} - 2807\,\mathrm{kJ}}$
これを(1)の方程式の形になるよう移項させていきましょう。
$\ce{6CO2}\mbox{(気)} + \ce{6H2O}\mbox{(液)} - \ce{6O2}\mbox{(気)} = \ce{C6H12O6}\mbox{(固)} - 2807\,\mathrm{kJ}$
$\ce{6CO2}\mbox{(気)} + \ce{6H2O}\mbox{(液)} = \ce{C6H12O6}\mbox{(固)} + \ce{6O2}\mbox{(気)} - 2807\,\mathrm{kJ}$
これより、$Q$ = -2807kJとなります。
これを(1)の方程式の形になるよう移項させていきましょう。
$\ce{6CO2}\mbox{(気)} + \ce{6H2O}\mbox{(液)} - \ce{6O2}\mbox{(気)} \\ = \ce{C6H12O6}\mbox{(固)} - 2807\,\mathrm{kJ}$
$\ce{6CO2}\mbox{(気)} + \ce{6H2O}\mbox{(液)} \\ = \ce{C6H12O6}\mbox{(固)} + \ce{6O2}\mbox{(気)} - 2807\,\mathrm{kJ}$
これより、$Q$ = -2807kJとなります。
エネルギー図を描いて求める方法だとどうなるか考えてみましょう。(1)の反応とⅠ~Ⅲの反応すべてをエネルギー図にすると、下の図のようになります。
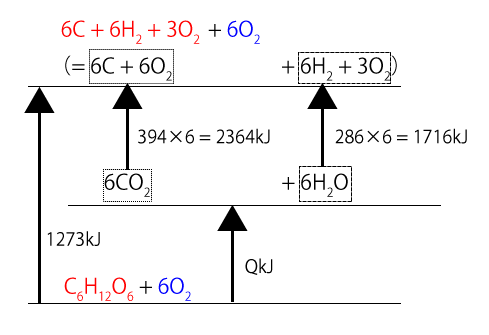
(1)とⅠについては、$\ce{C6H12O6}$について重複するところがあるので、Ⅰに書かれているものは赤字、書かれていないものは青字にしています。この図より、エネルギーについて、次のような方程式が成り立つはずです。
\( 1273 = 394×6+286×6+Q \)
これを解くと、
\( 1273 = 2364+1716+Q \)
\( Q = -2807 \)
この方法でも、-2807kJと求まります。
問3 ①・②:氷を加熱すれば(=エネルギーを与えれば)水になり、水を加熱すれば(=エネルギーを与えれば)水蒸気になります。よって、融解も蒸発も吸熱反応です。融解するときに吸収する熱量が融解熱、蒸発するときに吸収する熱量が蒸発熱です。
ちなみに、融解熱・蒸発熱以外に、このような反応熱があります。
- 燃焼熱…完全燃焼することで放出される熱量
- 溶解熱…多量の溶媒(水など)に溶かすことで放出または吸収される熱量
- 中和熱…酸と塩基が反応して水がつくられることで放出される熱量
- 生成熱…単体から化合物が生成されることで放出または吸収される熱量
③:水は水素と酸素という単体から生成されるわけですから、生成熱を$Q$kJとすると、水の生成熱は次のように表すことができます。
$\ce{H2}\mbox{(気)} + \ce{\displaystyle\frac{1}{2}O2}\mbox{(気)} = \ce{H2O}\mbox{(液)} + Q\,\mathrm{kJ}$
そして、水素の燃焼についてですが、燃焼すれば酸素と結びつき、その結果、水ができます。なので、水素の燃焼熱を$Q$kJとすると、次のように表すことができます。
$\ce{H2}\mbox{(気)} + \ce{\displaystyle\frac{1}{2}O2}\mbox{(気)} = \ce{H2O}\mbox{(液)} + Q\,\mathrm{kJ}$
注目する(1molに設定する)物質はちがいますが,結局、同じ熱化学方程式になりますから、その反応熱の値も等しくなります。
④:水($\ce{H2O}$)を構成する単体は$\ce{H2(気)}$と$\ce{O2(気)}$です。化合物と単体とでは、単体のほうが安定していない状態なのでエネルギーは大きい状態となっています。
そして、固体と気体とでは、気体のほうがエネルギーは大きいです(固体を加熱して蒸発させて気体になるので)。
このことをエネルギー図にまとめると、下の図のようになります。
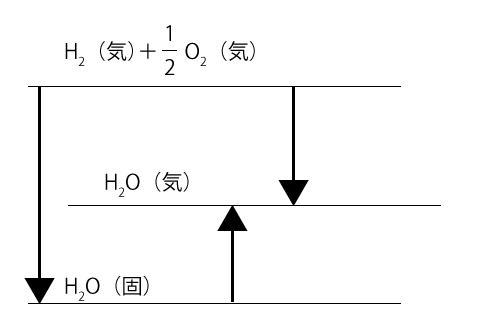
水(固)の生成熱は、一番左にある矢印、水(気)の生成熱は一番右にある矢印で表されていますから、水(固)の生成熱のほうが大きいということがこれでわかります。
⑤:液体のエネルギーは、固体より大きく、気体より小さいです(加熱していくと固体→液体→気体と変わっていくので)。④のときと同じようにエネルギー図にまとめると、下の図のようになります。
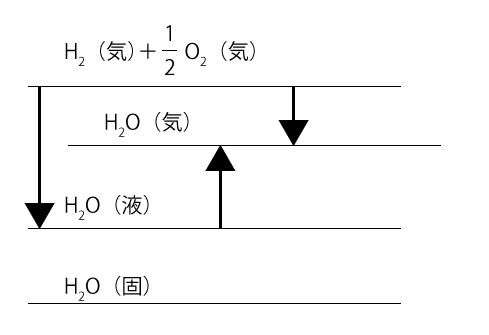
水(気)の生成熱は一番右にある矢印で表されています。水(液)の生成熱は一番左の矢印、水(液)の蒸発熱は真ん中の矢印で表されていますが、この長さをたしたものが一番右の矢印と等しくなるわけではありません。よって、これが誤りの文となります。
答え.
問1 ① 問2 ② 問3 ⑤