高校化学の問題演習
令和7年5月11日
同位体と原子量
※東北大学の入試問題を参考に作られています。
※入力は次の指示にしたがってください。
- 半角で入力し、かけ算の「かける」という記号のみ全角の×で入力すること。
- 累乗は、たとえば「3の2乗」なら3^2のように、^を使って入力すること。
次の文章を読み、問1から問4に答えよ。計算値はことわりのない限り、有効数字2
原子は、その中心にある1個の原子核と、それを取りまく何個かの電子で構成されており、原子核は、一般に正の電荷をもつ陽子と電荷をもたない中性子からできている。表1に示すように、自然界の多くの元素には同位体が存在し、その存在比はほぼ一定である。また、原子の相対質量は、炭素の同位体である$\ce{^{12}C}$の質量を基準に定められている。
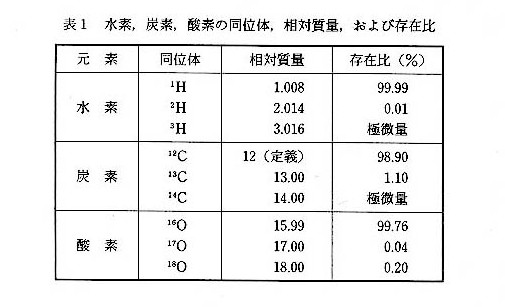
問1 水素の同位体の一つである$\ce{^{3}H}$は放射性であり、ベータ線($\ce{β^{-}}$)を放出する。この変換過程で生成する元素の記号を、解答例にならって、質量数を付けて記せ。〔解答例 $\ce{^{13}C}$〕
問2 炭素の同位体の一つである$\ce{^{13}C}$の原子核中の陽子数と中性子数を記せ。
問3 天然に存在する炭素は$\ce{^{12}C}$と$\ce{^{13}C}$の2種類の同位体のみを含むとして、炭素の原子量を有効数字4
問4 大気の二酸化炭素中には、放射性同位体である$\ce{^{14}C}$が存在する。生物体は、生きている限り大気中と同じ存在比で$\ce{^{14}C}$を保持しているが、死滅すると外界からの$\ce{^{14}C}$の取り込みが停止する。ある地層から出土した木片の極微量の$\ce{^{14}C}$の存在比を測定したところ、現在の存在比の1/4であることがわかった。この木は何年前まで生存していたかを推定せよ。ただし、$\ce{^{14}C}$の半減期は5700年とし、大気中の$\ce{^{14}C}$の存在比は数万年前から現在まで一定であると仮定する。
令和6年11月17日
窒素の化合物
※神戸大学の入試問題です。
※入力は次の指示にしたがってください。
- 用語を答える問題では、全角のみで入力すること。記号を答える問題では、全角カタカナのみ入力すること。
- 化学反応式や数値を答える問題では、半角のみ入力すること。ただし、矢印のみ全角の→で入力すること
- 化学式で下付き数字を使う場合は、たとえばH2OならH2Oのように、そのまま入力すること。
次の文章を読んで、問1~6に答えなさい。計算のために必要であれば、以下の値を用いなさい。
原子量:
$\ce{H}$ 1.00 $\ce{C}$ 12.0 $\ce{N}$ 14.0
$\ce{O}$ 16.0 $\ce{Cu}$ 63.5
硝酸は、次に示す四つの過程(①~④)を経て、窒素から合成される。
$\ce{N2}$\( \underset{①}{\longrightarrow} \)$\ce{NH3}$\( \underset{②}{\longrightarrow} \)$\ce{NO}$\( \underset{③}{\longrightarrow} \)$\ce{NO2}$\( \underset{④}{\longrightarrow} \)$\ce{HNO3}$と$\ce{NO}$
まず過程①では、四酸化三鉄を主体とした触媒を用いて、水素と窒素からアンモニアが直接合成される。
$\ce{N2 + 3H2 <=> 2NH3}$ …(A)
次に、白金を触媒とし、アンモニアを酸化することにより一酸化窒素が合成される(過程②)。
(B)
一酸化窒素は空気中で酸化され、二酸化窒素となる(過程③)。
$\ce{2NO + O2 -> 2NO2}$ …(C)
二酸化窒素を水と反応させることにより、硝酸が得られる(過程④)。
$\ce{3NO2 + H2O -> 2HNO3 + NO}$ …(D)
副生成物の一酸化窒素は反応(C)と反応(D)を繰り返し、最終的に硝酸となる。アンモニアから始まり硝酸ができるまでの反応(B),(C),(D)を1つの化学反応式で表すと、
(E)
となる。
問1 下線部のようにアンモニアを合成する方法を何と呼ぶか、答えなさい。
問2 (A)の反応は可逆反応である。アンモニアの生成率をよくするためには、高圧,低圧のどちらの条件下が望ましいか、答えなさい。また、その理由を30字以内で答えなさい。
問3 反応(B)と(E)を化学反応式で示しなさい。
問4 反応(A)~(E)で生成される一連の窒素化合物のうち、窒素原子の酸化数が最も小さいものについて、化学式と酸化数を示しなさい。
問5 硝酸について、下記の(ア)~(オ)の中から間違っている記述が含まれるものをすべて選びなさい。(答えが複数ある場合は、たとえばアとウを解答するならアウのように、記号と記号の間をあけずにそのままつづけて入力すること)
(ア) 硝酸は褐色の液体であり、熱や光で分解することを防ぐため、褐色瓶に入れて冷暗所に保存する。
(イ) 濃硝酸は強い酸性,希硝酸は弱い酸性を示す。
(ウ) 濃硝酸は強い酸化力があり、銅,銀,ニッケルを溶かす。
(エ) 硝酸イオンは、植物の根から吸収され窒素源として利用される。
(オ) 濃硝酸と濃硫酸の混合物を混酸と呼び、芳香族化合物のニトロ化反応に用いられる。
問6 銅と希硝酸を反応させると、銅は溶け、気体が発生した。
(1) 発生する気体は水上置換で捕集され、上方置換や下方置換では捕集することができない。この理由について、発生する気体の性質を二つ挙げて30字以内で説明しなさい。
(2) 63.5gの銅をすべて希硝酸と反応させたとき、何gの水が生成するか、有効数字3桁で答えなさい。
