この問題でおさえておきたいこと
酸化銅を使った酸化還元反応がどんなものかをしっかりおさえよう!
解答
1.あ 還元 い 酸化
2.$\ce{2CuO + C -> 2Cu + CO2}$
3.0.3グラム 根拠となる法則は、質量保存の法則
4.80%
解説
1.酸化銅と炭素を混ぜて加熱すると起こる化学反応式は以下のようになります。基本的な化学反応で、なおかつ重要な反応ですので、ぜひ覚えましょう。

すなわち、酸化銅は酸素を失って銅に戻り、そのかわりに炭素がその酸素と結びついて二酸化炭素に変わったという反応です。
ある物質が酸素と結びつく反応が酸化、逆に酸化されたものから酸素がなくなる反応が還元というんでしたね。
2.酸化銅と炭素から、銅と二酸化炭素がつくられます。
酸化銅は$\ce{CuO}$、炭素は$\ce{C}$、銅は$\ce{Cu}$、そして、二酸化炭素は$\ce{CO2}$です。これをもとに、化学反応式をつくっていけば、1.にある化学反応式ができますね。そのときのポイントは、係数です。
$\ce{CuO + C -> Cu + CO2}$
さっき出てきた化学式を並べると上のようになりますが、これだと、矢印の左側には、$\ce{O}$(酸素)原子が1個しかないのに対し、右側には、$\ce{O}$(酸素)原子が2個あることになり、つじつまが合わなくなります。
そこで、矢印の左側の$\ce{O}$(酸素)原子を2個にするために、$\ce{CuO}$の前に係数として2をつけるわけです。
ただし、そうなると今度は矢印の左側と右側で、$\ce{Cu}$(銅)原子の数が合わなくなります(左側は2個なのに、右側では1個だけとなります)。なので、$\ce{Cu}$(銅)原子の数を合わせるために、矢印の右側の$\ce{Cu}$の前に2をつけているわけです。
3.問題文に書いてあったことを整理すると以下のようになります。
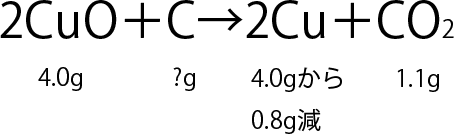
つまり、問題で聞かれている炭素以外の質量は、すべてわかっているということです。なので、化学反応し終わった後にできた物質の合計の質量が計算できます。
銅は4.0-0.8=3.2グラムでき、二酸化炭素は1.1グラムできたわけですから、3.2+1.1=4.3グラムできたことになりますね。
ということは、化学反応前の試験管の中にも、合計で4.3グラム入っていたことになります。そのうち、4.0グラムが酸化銅だったんですから、炭素は
4.3-4.0=0.3グラム
となります。
このように、化学反応の前でも後でも、関係する物質の質量の合計は変わらないということを示したのが質量保存の法則なわけです。
4.酸化銅は問題文で4.0グラムとありました。そして、完全に反応させた後にできた銅の質量は3.2グラムと3.で計算されましたね。よって、
3.2÷4.0×100=80%