この問題のポイント
分子の形を覚え、そこから極性分子か無極性分子かを判断できるようにしよう!
(i) 化学基礎の範囲では、これらの分子についてどのような形をしているかを覚えておく必要があります。
分子の立体構造
- 直線型…
水素分子($\ce{H2}$)
二酸化炭素分子($\ce{CO2}$)
塩化水素分子($\ce{HCl}$)
酸素分子($\ce{O2}$)
窒素分子($\ce{N2}$) - 折れ線型…
水分子($\ce{H2O}$) - 三角錐型…
アンモニア分子($\ce{NH3}$) - 正四面体型…
メタン分子($\ce{CH4}$)
よって、$\ce{CH4}$分子は正四面体型となっている選択肢のア,$\ce{NH3}$分子は三角錐型の構造になっている選択肢のオが正解です。
(ii) $\ce{CH4}$分子については、$\ce{C}$原子のまわりに$\ce{H}$原子が4つあるため、共有電子対が4組あることになり、非共有電子対はありません。しかし、$\ce{NH3}$分子については、$\ce{N}$原子のまわりに$\ce{H}$原子が3つしかないため、非共有電子対が1組できてしまいます。
【法則2】より、非共有電子対と共有電子対のほうが共有電子対どうしと比べて反発が大きいです。そのため、問題にある図3のオの図を借りると、$\ce{H}$原子3つはできるだけ$\ce{N}$原子から離れて下側のほうに位置しようとなっていき、下側に行こうとする力は図3のアの図における$\ce{H}$原子3つより強いということになります。
ということは、$\ce{NH3}$分子の$\ce{H}$原子は下のほうで少し密になる形になるので、$\ce{H-N-H}$結合角のほうが$\ce{H-C-H}$結合角よりも小さいということになります。解答としては、非共有電子対からの反発が大きいことを核に理由を説明して$\ce{H-N-H}$結合角のほうが小さいと結論付けるといいでしょう。
解答のチェックポイント
- $\ce{H-N-H}$結合角のほうが$\ce{H-C-H}$結合角よりも小さいという内容を書いているか
- 理由として非共有電子対によってスペースが大きくとられていることがわかる内容になっているか
- 非共有電子対がスペースを大きくとることは【法則2】の内容が根拠であることがわかる内容になっているか
(iii) 共有結合している2つの原子の間には共有電子対がありますが、それぞれの原子には共有電子対を引き寄せる力があります。この共有電子対を引き寄せる力のことを電気陰性度といいますが、2つの原子にこの電気陰性度の違いがあると、共有電子対は電気陰性度の大きいほうに引き寄せられます。
すると、電子はマイナスの電気を帯びているので、共有電子対を引き寄せたほうの原子は、少しだけマイナスの電気が強くなり、共有電子対が離れたほうの原子は、少しだけプラスの電気が強くなります。これによるプラスとマイナスの偏りを極性といいます。
極性があるかどうかを考えるには、分子全体で考える必要があります。たとえば、折れ線型や三角錐型の分子について電気陰性度の違いによって、原子間で黒い矢印の方向に共通電子対が偏るので、結果として赤い矢印の方向にマイナスの電気が偏ることになります。
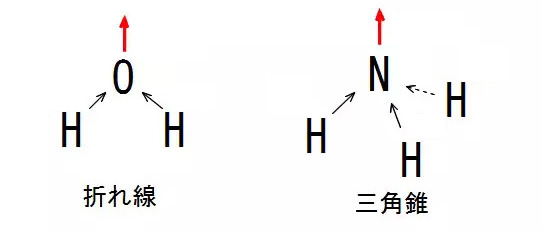
このように、分子全体で見ると極性がある分子を極性分子といいます。一方、$\ce{CH4}$や$\ce{CO2}$については、黒い矢印の方向に共通電子対が偏りますが、反対側から打ち消し合ったり、中央に向かったりして均等に偏ることになるので、マイナスの電気がどちらか片方にだけ偏ることがありません。
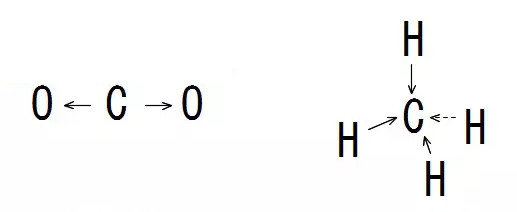
このように、分子全体で見ると極性がない分子を無極性分子といいます。折れ線型や三角錐型は極性分子、正四面体型は無極性分子であることが多いですが、極性分子か無極性分子かについて、これまでの説明のように、共有電子対がどちらへ引き寄せられるかを考えて分子全体でマイナスの電気が偏りがあるかで判断するといいでしょう。
ちなみに、直線型の分子については、極性分子か無極性分子かは、下のように分子によって変わります。やはり原子などから分子全体でどちらか一方向へマイナスの電気が偏るかどうかを考えるようにするといいですね。

さて、問題として出題された$\ce{CH4}$分子と$\ce{NH3}$分子について、$\ce{CH4}$分子は極性をもたない、$\ce{NH3}$分子は極性をもつことが、ここまでの説明でわかりました。理由についても、ここまでの説明のとおり、共有電子対が片側に引き寄せられるかどうかを軸に述べればじゅうぶんでしょう。
解答のチェックポイント
- $\ce{CH4}$分子は極性をもたない、$\ce{NH3}$分子は極性をもつことを述べているか
- $\ce{CH4}$分子が極性をもたない理由として、マイナスの電気の偏りがない(または、共有電子対が中心の$\ce{C}$原子の方向へ引き寄せられる)ことにふれているか
- $\ce{NH3}$分子が極性をもつ理由として、マイナスの電気の偏りがあることにふれているか
- 非共有電子対がどちらの方向に引き寄せられるかについて、それぞれふれているか
答え.
(i)
$\ce{CH4}$分子…ア $\ce{NH3}$分子…オ
(ii)(例)
$\ce{H-N-H}$結合角のほうが$\ce{H-C-H}$結合角よりも小さい。理由は、共有電子対どうしと比べて非共有電子対と共有電子対のほうが反発が大きく、その分空間を大きく使うが、$\ce{NH3}$分子にはその非共有電子対が1組あるため。
(iii)(例)
$\ce{CH4}$分子…極性をもたない。理由は、$\ce{CH4}$分子の中で共有電子対は中心の$\ce{C}$原子の方向へ四方向から引き寄せられる形となり、分子全体としての電気の偏りが起こらないため。
$\ce{NH3}$分子…極性をもつ。理由は、$\ce{NH3}$分子の中で共有電子対は$\ce{N}$原子の方向へ三方向から引き寄せられる形となり、分子全体では$\ce{N}$原子のある側にマイナスの電気が偏っているため。