この問題のポイント
立体異性体とは何か、幾何異性体と光学異性体の特徴は何かをおさえよう!
問1 そもそも立体異性体というのは、分子の立体的な構造が異なる異性体のことです。つまり、分子式・構造式は同じなんですが、立体的な並び方が違っているものどうしということです。
その立体異性体は幾何異性体(シス-トランス異性体)と光学異性体の2種類に分けられます。問1はそのうちの光学異性体についての問題です。
光学異性体とは、下の図のように、立体的構造がちょうど鏡に映し合ったときのような配置になっているものを指します。左手の手袋と右手の手袋のような関係といっていいでしょう。鏡に映し合ったような配置になっているだけなので、沸点や融点などの性質は同じなのですが、偏光(平面状に振動して進む光)に対する性質(光学的性質ともいう)は違っています。
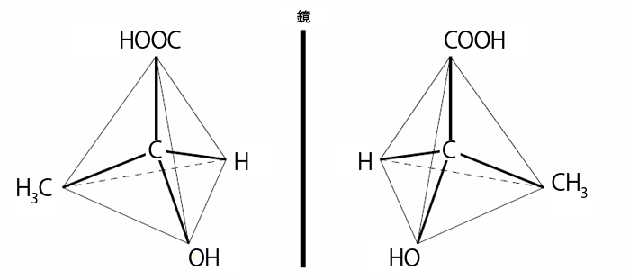
以上の説明をふまえて、a~dが正しいかを見ていきましょう。
a…さっきの説明に出た光学的性質について述べています。光学異性体では、その性質は違っているんですから、正しいです。
b…さっきの説明に出たとおり、沸点や融点は同じです。
c…左手の手袋を直接、右手の手袋の上に置いてもぴったり重なり合うことはありません。それと同じように、光学異性体も、鏡に映し合ったような関係ということは、直接重ね合うことは不可能です。それぞれが違った立体構造をしているといえます。
d…立体的な並び方だけが違うのですから、分子式は同じです。
よって、aとcを正しいとしている③が正解です。
なお、この光学異性体というのは、不斉炭素原子(まわりに結びついている原子団4つがすべて異なる炭素原子)が必ず存在するということもおさえておいてください。
問2 この問題では、幾何異性体というのが取り上げられていますが、幾何異性体というのは、炭素原子間の二重結合のまわりの部分が、回転すればぴったり重なり合う配置になっているものです。実際に二重結合を軸にして原子を回転させることはできないんで、異性体となっているわけです。たとえば、下の図のようなものです。
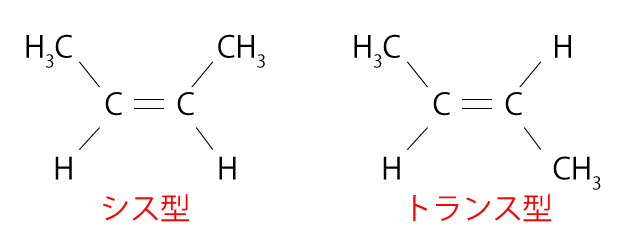
ちなみに、上の図のように、水素原子じゃない部分が同じ側にあるものをシス型、反対側にあるものをトランス型といいます。そして、さっきの光学異性体とちがって幾何異性体は、沸点や融点は違うことにも注意しておきましょう。
そして、幾何異性体といえる条件があります。上の図から考えることができますが、片方の炭素原子と結合している2つが異なるものどうし、さらにもう片方の炭素原子と結合している2つも異なるものどうしでなければなりません(上の図だと、どっちの炭素原子も$\ce{H}$と$\ce{CH3}$という2つが結びついています)。どっちかの炭素原子が同じ2つのものと結合していたら、片方を回転させてもまったく変わらないからです。
さて、それぞれの選択肢について、水素分子1つ、つまり$\ce{H}$原子2個を加えてみましょう。すると、①と③は、さっきの幾何異性体となる条件に合致しないことがわかります。
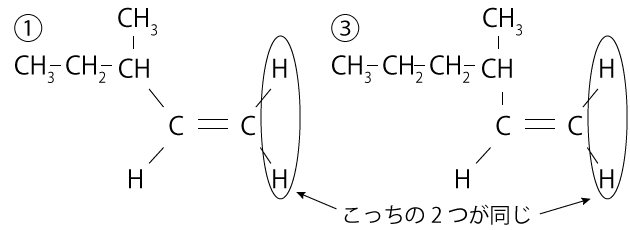
②、④、⑤については幾何異性体となるので、これらにしぼって、今度は水素分子2つがついた場合を考えてみましょう。すると、⑤だけが不斉炭素原子が存在するようになります。下の図のとおり、その不斉炭素原子のまわりには$\ce{C2H5}$、$\ce{CH3}$、$\ce{H}$、$\ce{C5H11}$と4種類のものが結びついていますね?
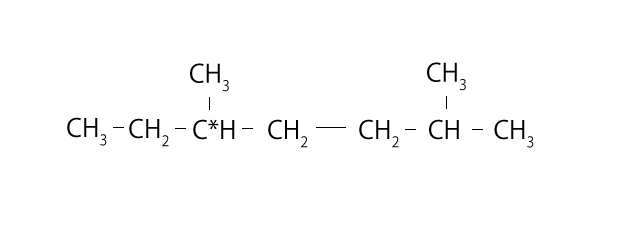
答え.
問1 ③ 問2 ⑤