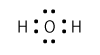この問題のポイント
イオン結合、共有結合、金属結合のちがいを正確におさえよう!
A~F イオン結合、共有結合、金属結合それぞれのちがいをおさえれば、簡単にうめられる問題です。
・イオン結合
非金属元素と金属元素をつなぐ結合。
金属元素は陽イオン、非金属元素は陰イオンになりやすく、そのプラスとマイナスの間に発生する静電気的な引力(クーロン力)によって引き合い、結合する。
静電気的な力によって引き合うのだから、陽イオンと陰イオンがある限り制限なく結合しあう。
・共有結合
非金属元素どうしをつなぐ結合。
2つの原子がお互いに相手の価電子(2個ペアになっていないあまった電子なので不対電子という)を共有して結合している。
ちなみに、2個ペアになっている電子のうち、原子間で共有されているものを共有電子対、共有されていないものを非共有電子対という。
・金属結合
金属元素どうしをつなぐ結合。
金属イオンは電子を放出して陽イオンになりやすいが、その電子が金属イオンのまわりを自由電子として飛び回ることで金属イオンをまとめて1つのかたまりにしている。
X~Z $\ce{H}$原子は価電子(一番外側の電子殻に入っている電子)が1個、$\ce{O}$原子は価電子が6個です。$\ce{O}$原子としては、あと2個の電子を入れることができる状態ですね?$\ce{H}$原子2個と共有結合をしているのは、このためですね。
このように結合をすると、$\ce{H}$原子にとっては価電子が2個となり、ちょうどヘリウム原子と同じ状態となります。$\ce{O}$原子にとっては価電子が8個となり、ちょうどネオン原子と同じ状態となります。ヘリウムもネオンもどちらも希ガスですから、このように考えると、〔 D 〕に入るのが希ガスというのもわかりやすいと思います。
答え.
問1
〔 A 〕…(カ) 〔 B 〕…(ウ)
〔 C 〕…(イ) 〔 D 〕…(セ)
〔 E 〕…(オ) 〔 F 〕…(キ)
問2
X…$\ce{He}$ Y…$\ce{Ne}$
Z…